Information
发布时间:2022-06-09
近日,美国德克萨斯州休斯顿莱斯大学生物工程系的Caleb J. Bashor教授,在Nature Reviews Drug Discovery 杂志上发表了一篇综述,系统总结了目前细胞疗法的进展与挑战,以及包括基因组和表观基因组编辑、合成生物学和生物材料在内的下一代可以解决细胞疗法障碍的生物工程方法。
细胞疗法的临床进展与挑战
细胞疗法是近年来医药研发中发展非常迅速的一个领域,而人们之所以对细胞疗法具有非常大的热情,主要是因为相比于其他化学或生物疗法,细胞疗法具有更具潜力的额疗效和安全性。
例如,生物制剂(包括重组蛋白和其他细胞衍生的生物分子)尽管可以利用大分子的识别能力来实现高度的靶标特异性,但它们容易产生不利的药代动力学 (PK) 和药效学 (PD)特性,从而限制其安全性和功效。同样地,基因治疗也面临着包括转基因表达定位以及适应性免疫反应在内的一系列安全问题。
尽管细胞疗法与基因疗法有许多相同的转化障碍,包括潜在致瘤性的安全性担忧和高制造成本,但细胞疗法有独特的内在特征,更具发展潜力。例如,细胞可以在特定组织或器官中自然迁移、定位甚至增殖。因此,细胞疗法在生物分布和靶向递送方面具有先天的优势,不仅优于生物制剂,也优于基因疗法。
人类细胞疗法于 1950 年代首次以骨髓移植的形式出现,用于血液肿瘤的治疗。这些治疗作为安全有效的护理标准的成功已成为细胞治疗疾病潜力的长期证据,并为近几十年使用脐带血来源的造血干细胞和造血祖细胞治疗获得监管部门批准铺平了道路。这些产品在临床上得到广泛应用,包括迄今为止 FDA 批准的多种细胞疗法。
然而,尽管在开发用于治疗其他疾病的细胞疗法取得了同步进展,但这些疗法的商业转化遇到了巨大的障碍。直到FDA 批准 CAR-T 疗法前后近10年的过程中,其他细胞疗法的商业化进展才显著加快。在此期间,用于难治性多发性骨髓瘤的 CAR-T 产品以及用于 ALL 和 LBCL 的其他产品已经进入市场,并且颇具前景的自然杀伤 (NK) 细胞的疗法也有了临床进展,且很可能获得监管部门批准。
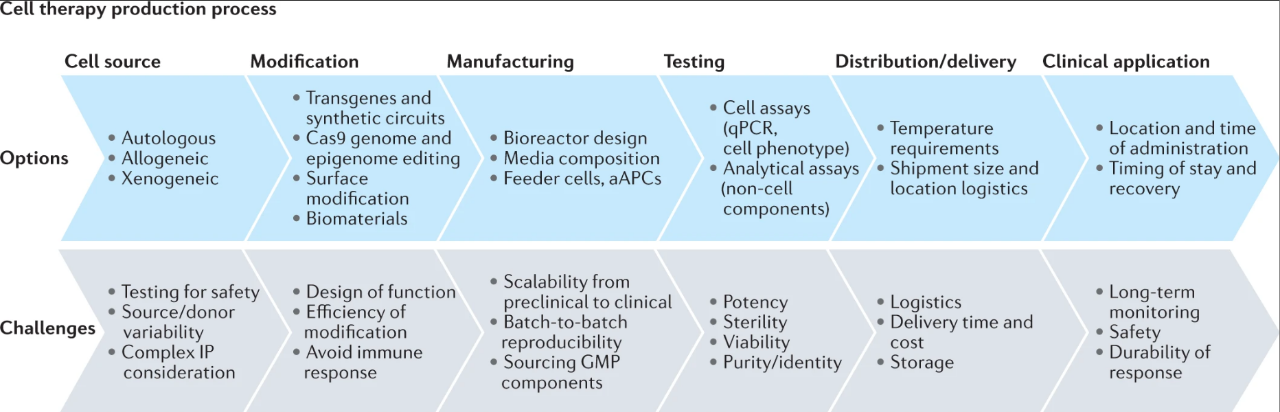
图:细胞疗法的流程(来源:Nature Reviews Drug Discovery)
除了癌症治疗,近年来,细胞疗法在几个新兴领域也取得了临床成功,包括自身免疫性疾病、中枢神经系统 (CNS)和神经退行性疾病、心血管疾病以及各种孤儿病。
其中一些疗法是使用间充质干细胞(MSC)开发的,它们具有良好的免疫调节和抗炎特性,作为细胞治疗产品的潜在来源受到了长期关注,并且具有良好的安全性。上述提到的治疗克罗恩病的目前在欧盟和日本提供上市的细胞疗法 darvadstrocel ,就是少数成功商业化的 MSC 产品之一。另一个著名的产品是 remestemcel-L,它使用供体衍生的、培养扩增的 MSC 来治疗 移植物抗宿主病。
虽然,近年来针对各种疾病的细胞疗法取得了重大进展,但依旧存在许多挑战,例如,寻找稳定的细胞来源、保证良好的安全性、限制与宿主免疫系统的不良反应以及提供质优价廉的治疗方案。
细胞工程创新为下一代细胞疗法铺平道路
为了应对细胞治疗中的巨大挑战,科学家进行了一系列的工程学科创新,包括基因组和表观基因组编辑、合成生物学和生物材料进展,其中部分方法已成功用于生产商业化产品。
CRISPR 和 CRISPR 相关 (Cas)蛋白的发展推动了基于细胞疗法的最新进展,这些蛋白作为可编程工具在活细胞中设计人类基因组和表观基因组。基于CRISPR-Cas的基因编辑技术主要通过人类细胞中的两种天然途径非同源末端连接(NHEJ)和同源定向修复(HDR)来实现。
尽管利用 Cas9 介导的 NHEJ 治疗单基因疾病此前已取重大的临床进展,但近年来针对多基因的改造也取得了实质性进展。例如,使用 CRISPR 同时靶向 T 细胞受体 (TCR)、β 2 -微球蛋白 (β 2 m) 和 PD1 基因的基因组编辑与慢病毒递送的 CAR 结合使用,生成缺乏 TCR、HLA I 和 PD1 的同种异体 CAR-T 细胞,为通用型 CAR-T 细胞治疗铺平了道路。
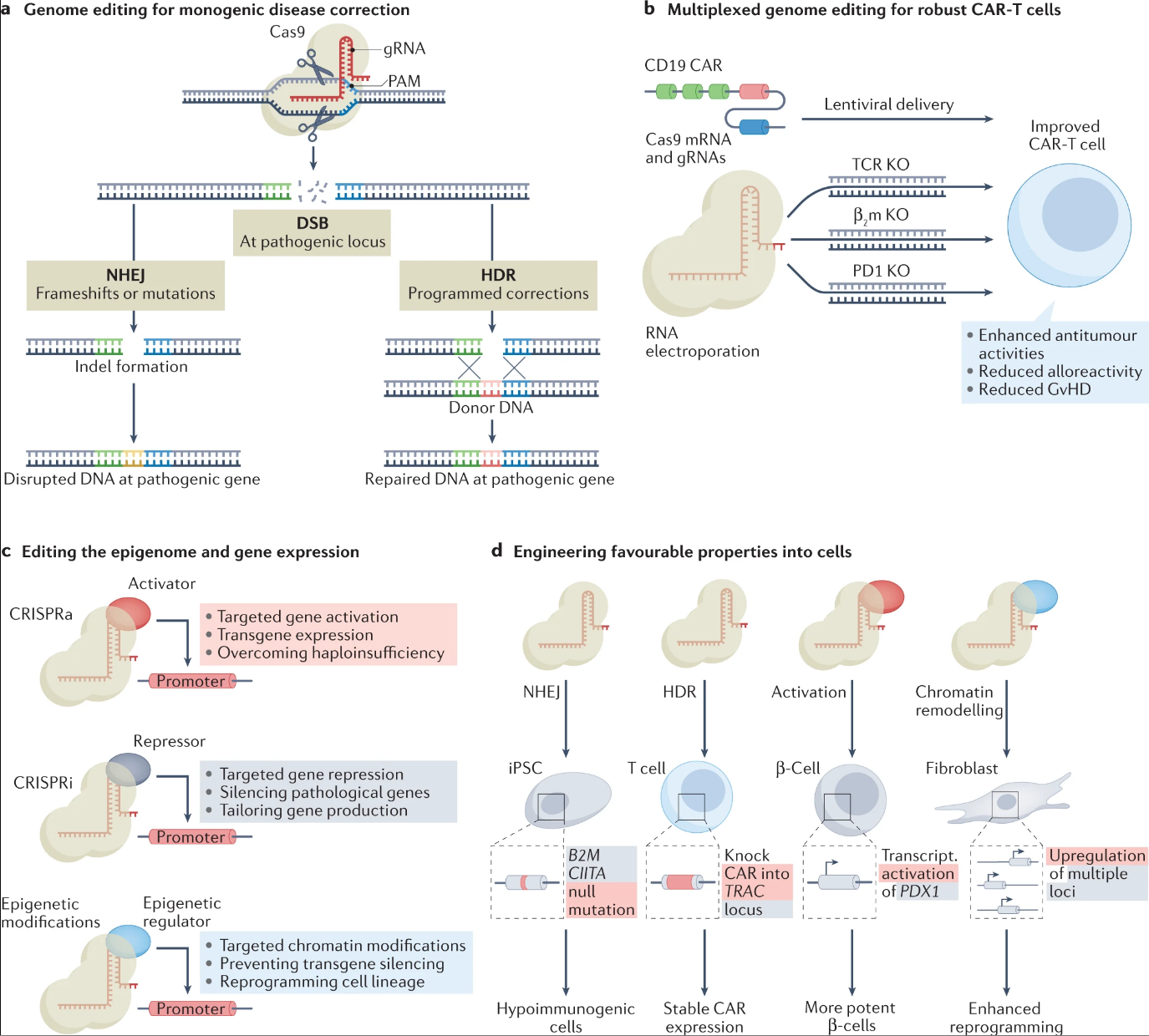
图:利用 CRISPR–Cas 介导的基因组编辑来改进细胞疗法(来源:Nature Reviews Drug Discovery)
围绕使用 NHEJ 进行基因组编辑以构建细胞的疗法的一个混杂因素是 NHEJ 之后造成的DNA双链断裂可能是不可预测的。相比之下,HDR 可以精准预测基因组的变化。例如,基于 CRISPR-Cas 的 HDR 已被用于提高 CAR-T 细胞疗法的稳健性,通过将 CD19 特异性 CAR 引导至 T 细胞受体 α 链 (TRAC) 基因座以实现更均匀的 CAR 表达和增强效力。
除了正在进行的临床试验和创建新的CAR平台方面取得进展外,基因组编辑在开发通用型工程细胞方面发挥了重要作用。例如,经过编辑以去除CD7和TRAC的人类 T 细胞显示出对抗 T 细胞急性淋巴细胞白血病 (T-ALL) 的效力,而不会出现异种移植物抗宿主病。
目前临床上,基因组编辑技术的进展已扩展到许多严重的疾病,包括细菌感染(NCT04191148)、β-地中海贫血和镰状细胞病(NCT03655678;EDIT-301) , 血友病 B (NCT02695160) 和粘多糖贮积症 II (例如, NCT03041324)等。
总而言之,基因组和表观基因组编辑的结合推动了细胞治疗的发展。如上所述,这些新兴技术的发展可以进一步改善人类细胞治疗的疗效和安全性。
几十年来,人们一直在寻求使用基因工程将转基因或人工基因引入治疗细胞,作为创造更安全、更有效的细胞产品的一种手段。过去20年来合成生物学的快速发展,通过应用定量设计规则使基因工程结果更加精确、可预测和可重复。
合成生物学近年来在人体工程细胞领域取得了重要进展,这一进展在很大程度上是通过精确控制治疗性转基因表达或分泌治疗因子的传递,或通过对细胞进行编程以感知与特定组织或疾病状态相关的生物分子种类,可以增强基于细胞的治疗的可能性。
近年来报道的合成生物学在基于细胞的治疗中的应用范围非常广泛,从工程蛋白构建的简单开关模块到多组分“电路”——人工基因和蛋白质调控网络,将特定分子输入转化为治疗输出。
最近使用合成生物学解决过继性 T 细胞疗法中与特异性和活性相关的挑战工作证明了这一系列方法的可行性。在这一领域最成功的应用之一是一种蛋白质安全杀伤开关,该开关被设计用于导致移植细胞凋亡。
该开关的嵌合设计特点是将人类半胱天冬酶 9 融合到经过修饰的人类 FK 结合结构域,从而在施用小分子药物 AP1903 后实现凋亡信号的二聚化和激活。虽然最初开发用于在干细胞移植过程中消除同种异体反应性 T 细胞,但该开关随后用于 CAR-T 治疗的临床试验,以限制 CRS 时效应细胞的增殖。
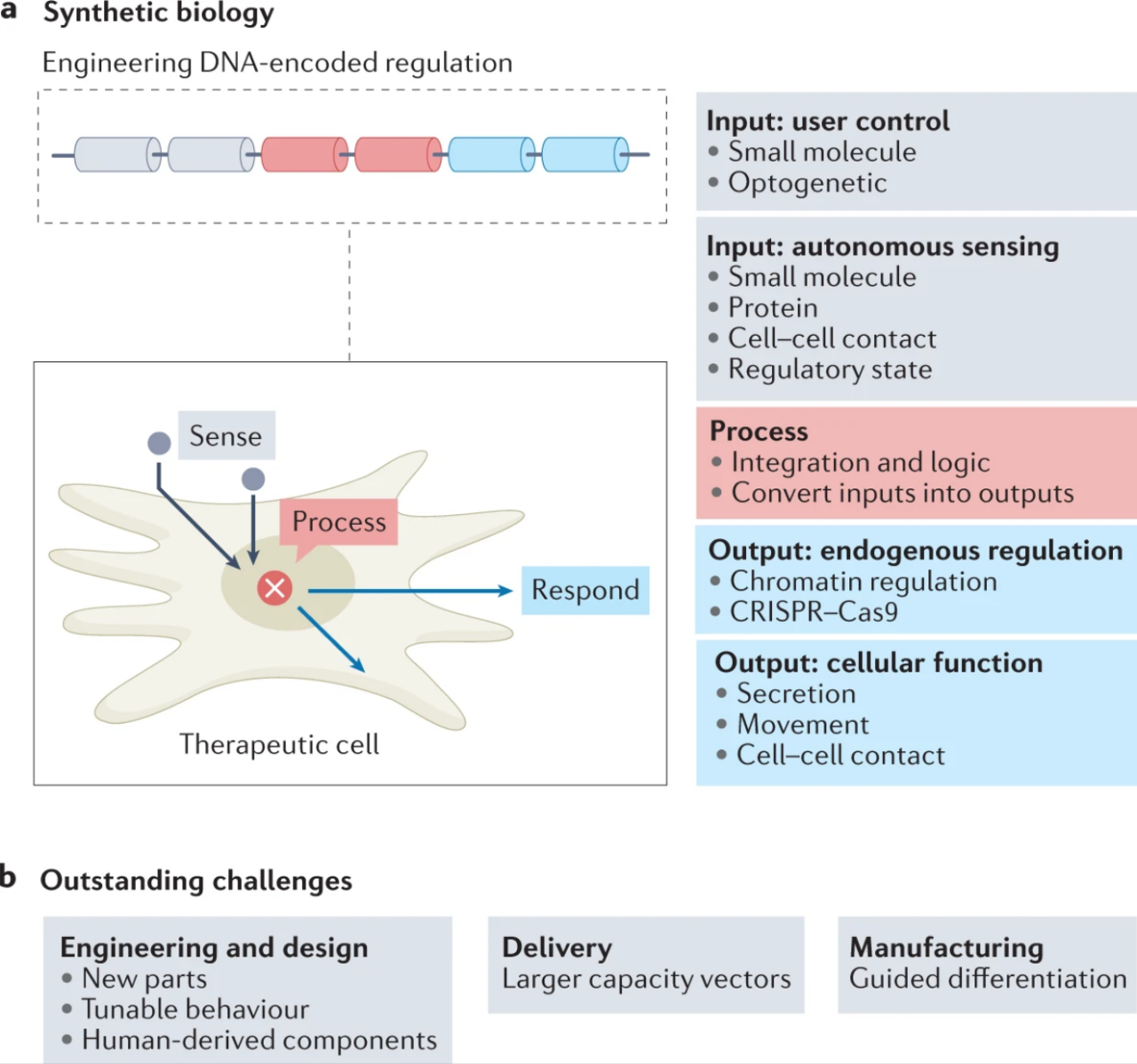
图:使用合成生物学方法增强细胞疗法功能特性(来源:Nature Reviews Drug Discovery)
CAR-T 合成生物学最近的一个重要焦点是开发增强肿瘤靶向特异性的策略,着眼于实现实体瘤治疗。一个众所周知的例子,最初由 Lim 及其同事开发的一种受体介导的基因调控电路设计,其中一个工程嵌合 Notch 受体附加到单链抗体上,在与相邻细胞表面的配体结合时触发,导致转录激活因子的蛋白水解释放和转基因表达。
克服将复杂“电路”精确传递到治疗细胞的相互依赖挑战的解决方案将使合成生物学专注于开发具有多方面功能的程序,这些程序可以同时编码疾病特异性作用模式、安全机制和“电路”稳定性,同时建立和维护相关的细胞内在特性。
半渗透性生物材料和水凝胶已被用于改善治疗细胞的输送、活力、保存和安全性。目前,人们已经探索了从可降解水凝胶到不可降解塑料以及金属的各种生物材料制剂作为支架,改善递送和细胞活力,促进细胞在特定体腔内的保留,促进控释或实现可回收性。
在许多临床前研究和早期临床试验中,这些方法已被证明在改善基于细胞的疗法的治疗结果方面具有重要作用。然而,该领域的一个主要目标仍然是开发长期功能性免疫分离解决方案,以使用同种异体细胞疗法。
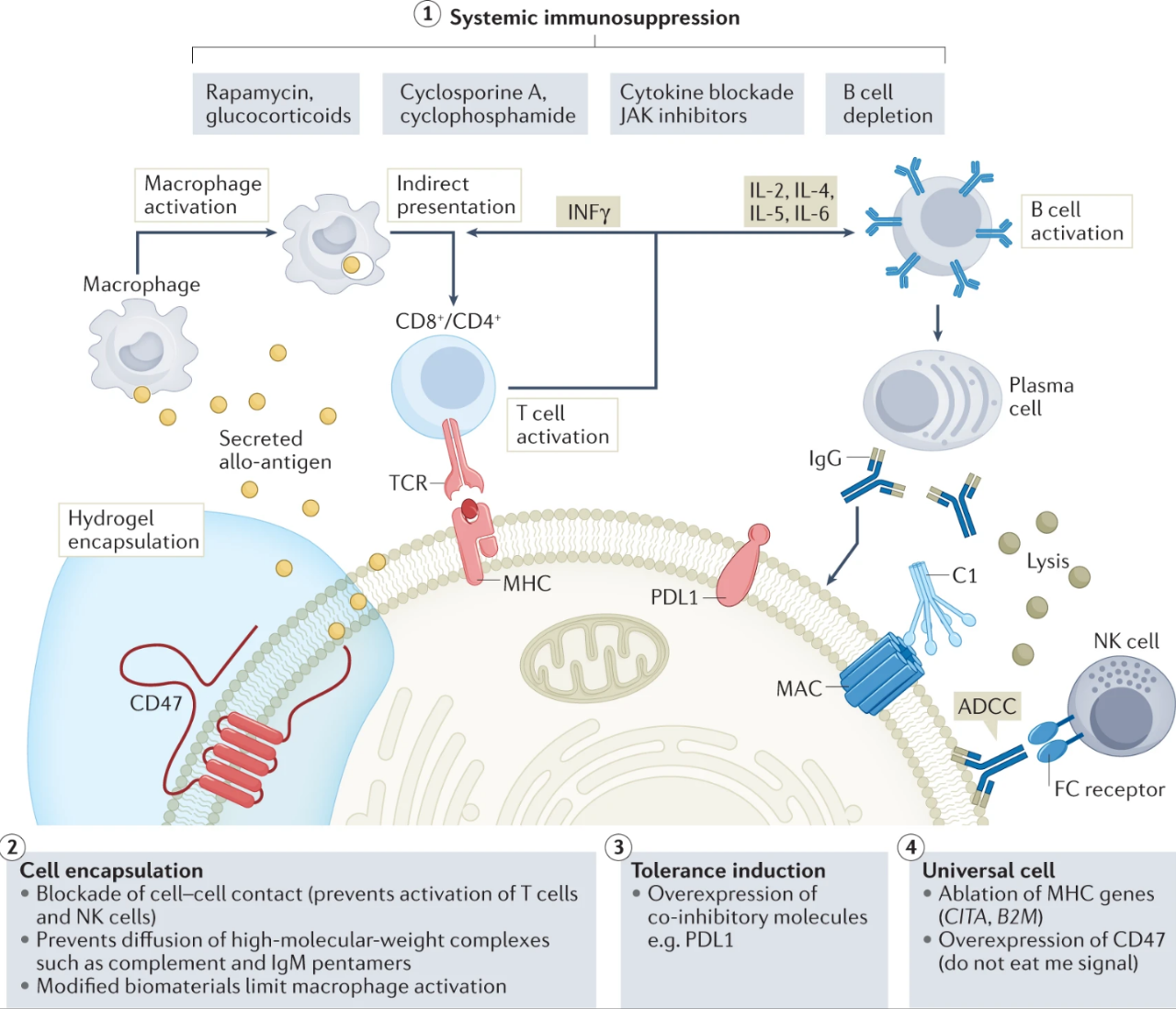
图:克服同种异体细胞治疗免疫排斥的新材料策略(来源:Nature Reviews Drug Discovery)
介导异体细胞排斥的免疫机制需要细胞间接触。在临床前研究和临床试验中积极探索的一种策略是使用半孔膜内对同种异体来源的细胞进行封装实现免疫隔离。这些努力的目标是将移植的细胞从患者自身的免疫系统中隔离出来,同时允许可溶性因子的双向运输;例如,葡萄糖和氧气等营养物质的流入,以支持移植细胞的长期存活以及它们产生的治疗性蛋白质的输出。
通过使用藻酸盐水凝胶促进大鼠胰岛的免疫隔离,首次证明了这一方案在动物中的可行性。这项研究显示了免疫活性动物中短期(数周)同种异体细胞移植的功能。
尽管封装已被证明在通过受体的适应性免疫反应阻止 MHC 介导的同种异体细胞识别和延长移植细胞的存活方面非常有效,但移植细胞的长期存活率是受限于封装生物材料的特征性异物反应 (FBR) 的发展。
免疫调节小分子修饰水凝胶,理论上可以防止任何FBR。已经证明了一种独特的基于藻酸盐的水凝胶中的化学修饰策略,该策略使用小分子来调节宿主免疫识别。另一种减轻生物材料 FBR 的有希望的方法是使用超低污染的两性离子生物材料。蛋白质吸收被认为是宿主免疫激活和纤维化的关键协调者。两性离子水凝胶创造了一种超亲水性生物界面,用于限制蛋白质的吸收。
总体而言,鉴于细胞治疗在临床应用中具有广阔的前景,上述基因组和表观基因组编辑、合成生物学和生物材料介导的免疫调节的发展——将在创建具有更高疗效、安全性和患者可及性的新产品管线中发挥越来越大的作用。